RADIANCE-Studie
Für Ärzte
Wir freuen uns, Ihnen mitteilen zu können, dass die Rekrutierung der RADIANCE Studien am 06.09.2023 abgeschlossen werden konnte. Wir bedanken uns bei allen aktiven Zentren!
Einleitung
Sehr geehrte Kolleginnen und Kollegen,
wir freuen uns, dass Sie sich über unsere Studie informieren. Selbstverständlich stehen wir und alle teilnehmenden Zentren Ihnen bei Rückfragen zu einem möglichen Studieneinschluss Ihrer Patienten zur Verfügung.
Sie finden auf den nachfolgenden Links einen Flow Chart der Studie, sowie weitere Informationen.
Studienregister international und national:
Hintergrund
Die Inzidenz des Analkarzinoms stieg in den westlichen Industrienationen in den letzten Dekaden deutlich an. Für die Ätiologie des Analkarzinoms spielt die Infektion mit dem Humanen Papillomavirus (HPV) eine entscheidende Rolle. Der Nachweis von HPV im Tumorgewebe gelingt in 85 - 100% aller Patienten. Standardbehandlung ist seit Jahrzehnten unverändert die definitive, Radiochemotherapie (RCT) mit 5-Fluorouracil (5-FU) und Mitomycin C (MMC). Die Salvage-Operation kommt nur bei klinischem Nicht-Ansprechen des Tumors nach RCT oder bei lokoregionärem Rezidiv zum Einsatz. Bislang durchgeführte randomisierte Studien konnten weder einen Vorteil für eine zusätzlich Chemotherapie als Induktionstherapie vor RCT, noch als additive Therapie nach RCT zeigen. Auch die Dosiseskalation der Strahlentherapie zeigte in Phase-III-Studien keinen signifikanten Vorteil. Trotz der insgesamt guten Prognose des Analkarzinoms, insbesondere für frühe Tumorstadien (T1-2N0), beträgt das krankheitsfreie Überleben für lokal fortgeschrittene Tumore (T3-4N0, TanyN+) nach Standard-RCT nur etwa 60%. Für letztere Patientengruppe ist eine weitere Therapieoptimierung daher dringend notwendig.
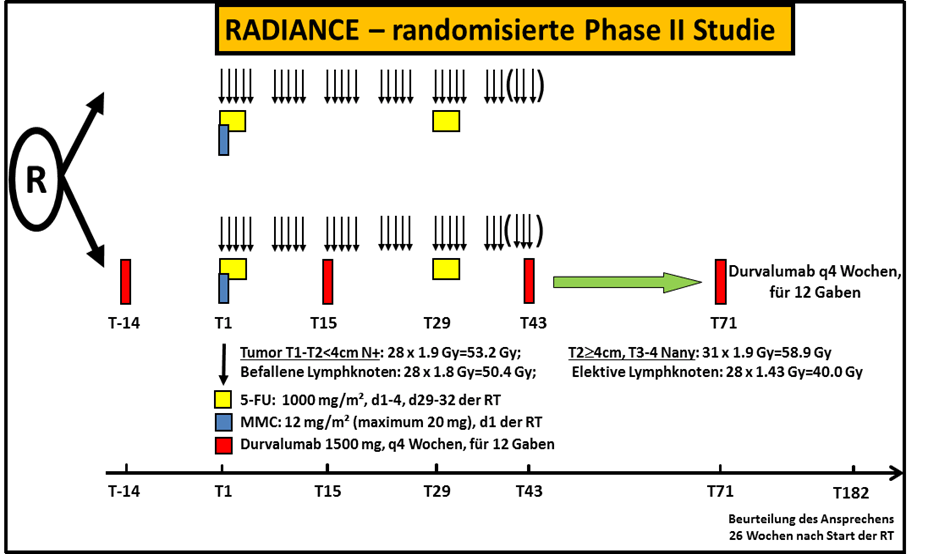
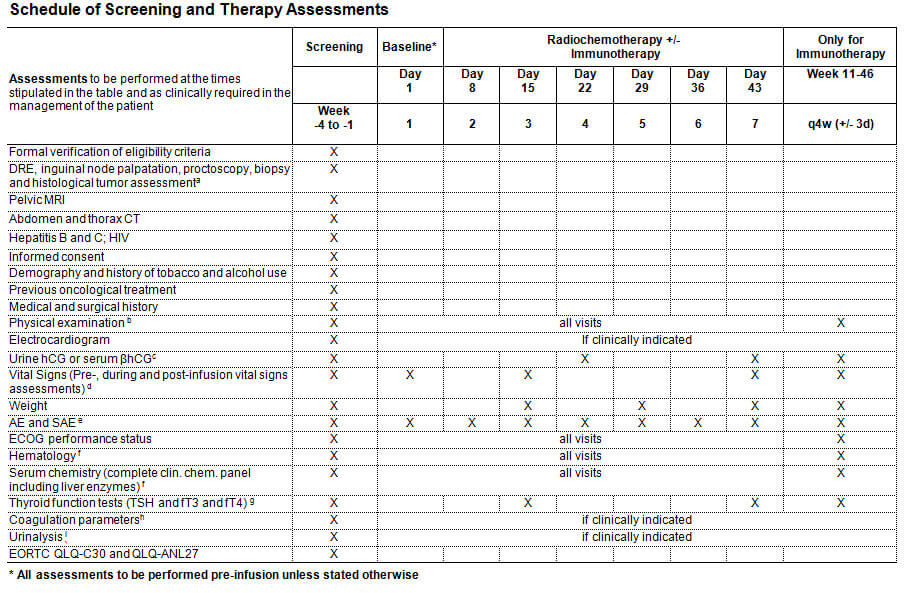
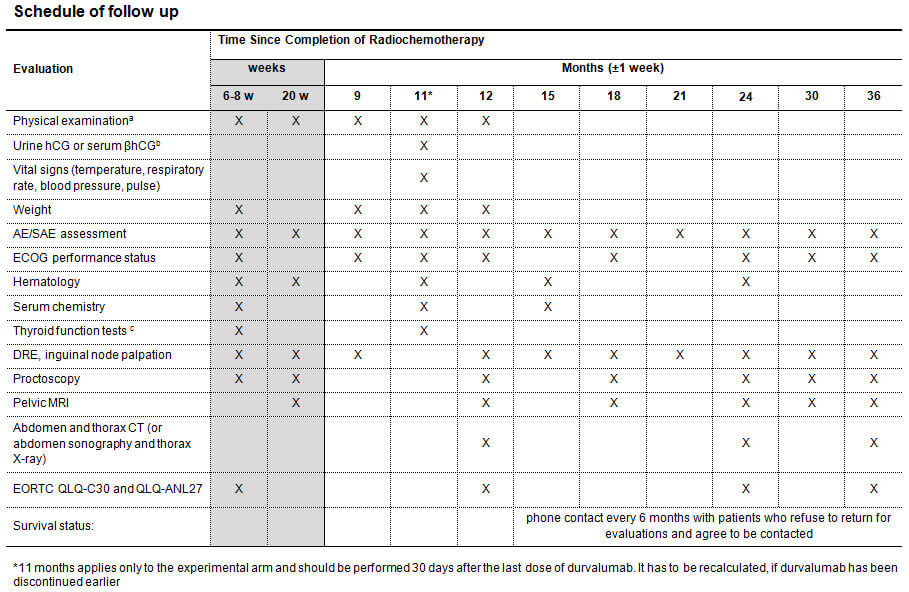
Die RADIANCE-Studie ist eine multizentrische, offene, randomisierte Phase II-Studie, die für Patientinnen und Patienten mit Analkarzinom testet, ob sich durch Hinzunahme des Programmed-death-Ligand 1 (PD-L1)-Inhibitors Durvalumab zur Standard-RCT das Krankheitsfreie Überleben gegenüber der alleinigen RCT mit 5-FU/MMC verbessern lässt (Abb. 1 Studiendesign). Eingeschlossen werden Patientinnen und Patienten mit einem histologisch nachgewiesenen, lokal fortgeschrittenem Plattenepithelkarzinom des Analkanal-/Analrandes in den Tumorstadien T2≥4cm Nany, T3-4N0 oder TanyN1 (UICC-Stadien IIB-IIIC).
Der primäre Endpunkt ist das krankheitsfreie Überleben (Disease free survival, DFS). Die Hypothese ist, dass eine Verbesserung des DFS nach 3 Jahren von 60% im Kontrollarm auf 80% im experimentellen Arm gezeigt werden kann. Dafür ist ein Stichprobenumfang von 178 Patienten (89 in jedem Arm bei 1:1 Randomisierung, inklusive 10% drop-out-Rate) bei einer Power von 80% und einem einseitigen Typ-I-Fehler von 2,5% notwendig. Sekundäre Endpunkte umfassen die Therapiedurchführbarkeit, Akut- und Spättoxizität, Aspekte der Lebensqualität und funktionale Langzeitergebnisse, die kumulative Rate an Komplettremissionen, Lokalrezidiven, Fernmetastasen, Kolostomiefreies-Überleben sowie das Gesamtüberleben. Zwanzig bundesdeutsche Zentren haben bereits ihre Teilnahme an dieser multizentrischen Studie zugesagt, darunter alle Standorte des Deutschen Konsortiums für Translationale Krebsforschung (DKTK). Ein translationales Begleitprojekt zum molekularen Profiling und zum Monitoring der immunmodulierenden Effekte der Kombinationstherapie wird in Kooperation mit der DKTK-ROG (Radiation Oncology Group) und dem Frankfurt Cancer Institute (FCI) unter Leitung von Prof. Fokas, Frankfurt, aufgelegt.
Weitere Informationen
- RADIANCE-Rekrutierungsstand Apr 2023
- 5. Studientreffen am 29.04.2022 Translationale Aspekte (PDF, 1,73 MB, Passwort geschützt*)
- Studienprotokoll (Passwort geschützt*)
* Sollten Sie noch kein Passwort haben, können Sie es bei uns anfragen.
Kontaktdaten Studiensekretariat
Tel.: 069/6301-3742